コンピュータ化システムバリデーションの基礎となるGMP省令の3大目的
- コンピュータ化システムバリデーションを勉強するとGMPという単語をよく見かけました。
- GMPとは、日本における「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」のことです。
- 誰が作業しても、いつ作業しても、必ず同じ品質・高い品質の製品をつくるために、医薬品製造業者が守るべきルールです。
- 目的を達成するためにやること
- 国や会社によってばらつきがあります。
コンピュータ化システムバリデーションを勉強するとGMPという単語をよく見かけました。
GMPとは、日本における「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」のことです。
- 英語 : Good Manufacturing Practice
- 日本語 : 適正製造規範
ざっくりいうと「安心して製品を使えるようにやらなければならないこと」です。
GMPは、医療分野以外にも食品などの製造業でも使われます。
日本の製薬・医療業界では「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」を指すことが多いです。
この省令は、GMP省令とも言います。
「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」は薬事法の14条に基づいています。
14条では「医薬品等の製造販売の承認」に始まり承認の基準や審査について記載されています。
GMPは、医薬品製造業における製造管理と品質管理の基準です。
健康食品や化粧品にも適用される基準です。
省令を読んでもよくわかりません。
書いてある文字列が難しくてよくわからないので、GMPを説明しているサイトと合わせて学びます。
誰が作業しても、いつ作業しても、必ず同じ品質・高い品質の製品をつくるために、医薬品製造業者が守るべきルールです。
目的は、大きく3つあります。
人による間違いを最小限にする。
医薬品が汚染されたり、品質が低下するのを防ぐ
高い品質を保つ仕組みをつくる
目的を達成するためにやること
(ハード)薬を作る製造所の環境や設備
GMP省令ではこんな感じで書いてあります。
(構造設備)
第九条 製品の製造所の構造設備は、次に定めるところに適合するものでなければならない。
一 手順書等に基づき、その用途に応じ適切に清掃及び保守が行われ、必要に応じ滅菌され、また、その記録が作成され、保管されていること。
二 製品等により有毒ガスを取り扱う場合においては、その処理に要する設備を有すること。
三 作業所のうち作業室は、製品の種類、剤型及び製造工程に応じ、じんあい又は微生物による汚染を防止するのに必要な構造及び設備を有していること。ただし、製造設備等の有する機能によりこれと同程度の効果を得られる場合においては、この限りでない。
四 作業所のうち、原料の秤量作業、製品の調製作業、充てん作業又は閉そく作業を行う作業室は、当該作業室の職員以外の者の通路とならないように造られていること。ただし、当該作業室の職員以外の者による製品への汚染のおそれがない場合においては、この限りでない。
五 飛散しやすく、微量で過敏症反応を示す製品等又は交 叉さ 汚染することにより他の製品に重大な影響を及ぼすおそれのある製品等を製造する場合においては、当該製品等の関連する作業室を専用とし、かつ、空気処理システムを別系統にしていること。
六 製品の製造に必要な質及び量の水(設備及び器具並びに容器の洗浄水を含む。)を供給する設備を有すること。
・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(◆平成16年12月24日厚生労働省令第179号)
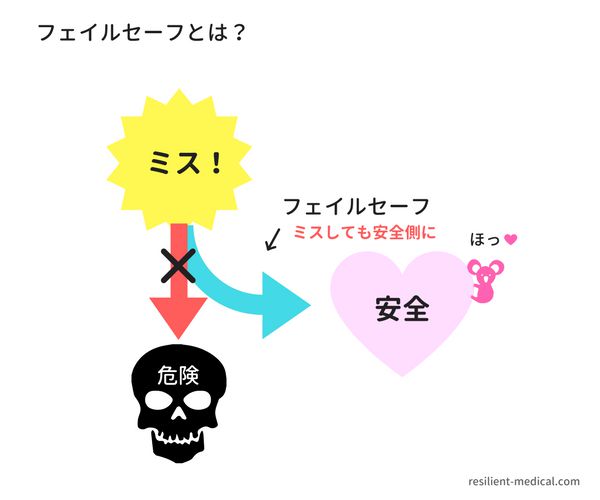
間違いを防ぐことができること
フェールセーフ/フェールプルーフに似ています。
医療系のシステム開発では、設計段階から「ユーザ操作に間違いがあったら?」の目線が必要になりますね。
https://resilient-medical.com/human-error/fail-safe-fool-proof
衛生的であること
(ソフト)人によるルールの運用
ルールを決めてそれを書類に残すこと
GMP省令では作る手順書の種類を具体的に決めています。
医療系のシステム開発では、仕様書や手順書の作成が重要となります。
(手順書等)
第八条 製造業者等は、製造所ごとに、構造設備の衛生管理、職員の衛生管理その他必要な事項について記載した衛生管理基準書を作成し、これを保管しなければならない。
2 製造業者等は、製造所ごとに、製品等の保管、製造工程の管理その他必要な事項について記載した製造管理基準書を作成し、これを保管しなければならない。
3 製造業者等は、製造所ごとに、検体の採取方法、試験検査結果の判定方法その他必要な事項を記載した品質管理基準書を作成し、これを保管しなければならない。
4 製造業者等は、前三項に定めるもののほか、製造管理及び品質管理を適正かつ円滑に実施するため、次に掲げる手順に関する文書(以下「手順書」という。)を製造所ごとに作成し、これを保管しなければならない。
一 製造所からの出荷の管理に関する手順
二 バリデーションに関する手順
三 第十四条の変更の管理に関する手順
四 第十五条の逸脱の管理に関する手順
五 品質等に関する情報及び品質不良等の処理に関する手順
六 回収処理に関する手順
七 自己点検に関する手順
八 教育訓練に関する手順
九 文書及び記録の管理に関する手順
十 その他製造管理及び品質管理を適正かつ円滑に実施するために必要な手順
5 製造業者等は、製品標準書、衛生管理基準書、製造管理基準書、品質管理基準書及び手順書(以下「手順書等」と総称する。)を製造所に備え付けなければならない。
・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(◆平成16年12月24日厚生労働省令第179号)
ルール実行するための手順書をSOPともいいます。
SOP(Standard Operating Procedures)とは標準業務手順書の略称で、治験の際に必ず守るべき基本的な業務手順をまとめた手順書。
SOPとは | 製薬業界 用語辞典 | Answers(アンサーズ)
ルールの実行結果を記録に残して証拠にすること
GMP省令には「記録を作成し、これを保管すること」がたくさんあります。
医療系のシステム開発では、エビデンスをきっちりと残して管理する必要があります。
(製造管理)
第十条 製造業者等は、製造部門に、手順書等に基づき、次に掲げる製造管理に係る業務を適切に行わせなければならない。<省略>
三 製品の製造に関する記録をロットごと(ロットを構成しない製品については製造番号ごと。以下同じ。)に作成し、これを保管すること。
四 製品の資材についてロットごとにそれが適正である旨を確認するとともに、その結果に関する記録を作成し、これを保管すること。
五 製品等についてはロットごとに、資材については管理単位ごとに適正に保管し、出納を行うとともに、その記録を作成し、これを保管すること。
六 構造設備の清浄を確認するとともに、その結果に関する記録を作成し、これを保管すること。
七 職員の衛生管理を行うとともに、その記録を作成し、これを保管すること。
八 構造設備を定期的に点検整備するとともに、その記録を作成し、これを保管すること。また、計器の校正を適切に行うとともに、その記録を作成し、これを保管すること。
・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(◆平成16年12月24日厚生労働省令第179号)
内容を見直して検討・改善していくこと
手順の作成と記録だけではなく、定期的に記録をチェックして状況や環境の変化に合わせた改善が必要になります。
(製造管理)
第十条 製造業者等は、製造部門に、手順書等に基づき、次に掲げる製造管理に係る業務を適切に行わせなければならない。<省略>
九 製造、保管及び出納並びに衛生管理に関する記録により製造管理が適切に行われていることを確認し、その結果を品質部門に対して文書により報告すること。
・医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(◆平成16年12月24日厚生労働省令第179号)
国や会社によってばらつきがあります。
ざっくり似ていても世界各国全く同じ基準ではありません。
PIC/Sでは、GMP基準の国際化を目指しています。
- 正式 : Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme
- 日本語 : 医薬品査察協定及び医薬品査察共同スキーム
PIC/Sは、GMPの分野で共通の基準を設け、各国の査察官にトレーニングの機会を提供することによって、世界中の査察基準を整合させることを目指しています。
PIC/Sの基礎知識。PIC/S GMPとは?PIC/Sの目的や成り立ちは? | コラム | 平原エンジニアリングサービス│医薬品施設のエンジニアリング
GMPの歴史
- 1961年 サリドマイドの薬害について報告される
- 1963年 (アメリカ)FDA(アメリカ食品医薬品局)が、連邦食品・医薬品・化粧品法に基づいて医薬品等の製造品質管理基準を定めた
- 1969年 世界保険機関がWHO-GMPを制定し、加盟国に対して医薬品貿易においてGMPに基づく証明制度を採用・実施するように勧告
- 1980年 (日本)薬事法改正に伴い「医薬品GMP」施行
- 1990年 (日本)「原薬GMP」施行
- 1994年 (日本)「医薬品GMP」「原薬GMP」を合わせた「医薬品の製造管理及び品質管理規則」施行し、これが製造業の要件となった
- 1995年 PIC/S設立
- 2005年 (日本)「医薬品及び医薬部外品の製造管理及び品質管理規則」が「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」へ改正され、製造販売承認の要件となった
- 2014年 日本がPIC/Sに加盟