- ピュータ化システムバリデーションは、製薬業界や医療機器業界で使われる品質保証のことです。
- 目的は、システムが意図したとおりに動作することを保証することです。
- そんなCSVにはガイドラインがあります。
- 製薬や医療業界のシステム開発で使われる工程の略称
- 歴史
ピュータ化システムバリデーションは、製薬業界や医療機器業界で使われる品質保証のことです。
- 英語 : Computerized System Validation
- 略称 : CSV
一般工業製品の品質保証となぜ分けているのか?
一般工業製品の場合は「価格」と「品質」が比例します。
安ければある程度の不良は許容されます。
医薬品は、生命にかかわるため不良は許容されないから
医薬品の場合は「価格」にかかわらず「不良」は許容されません。
そのため、世界的にCSVへの取組が求められています。
日本医療機能評価機構のサイトでシステムに関わる医療事故を見ることができます。
日本医療機能評価機構のサイトから「分析テーマ」で「その他」を選ぶと見られます。
www.med-safe.jp
GMP省令が基礎となっています。
GMPの対象のうち製薬や医療に関わるコンピュータ化システムが対象になります。
医療機器に組み込まれるシステムだけではなく、文書を管理するシステムまで
医療に関わる広範囲のシステムが対象になります。
2. 適用の範囲
このガイドラインは、コンピュータ化システムを使用してGQP省令及びGMP省令が適用され る業務を行う製造販売業者等に適用する。
このガイドラインの対象となるコンピュータ化システムの例として、(1)~(7)が考えられる。また、対象外となるコンピュータ化システムは別紙2に記載する。
(1) 医薬品、医薬部外品の市場への出荷の可否の決定に係るシステム及び市場への出荷に係る記録を 作成、保存管理するためのシステム
(2) 製造指図書、製造に関する記録等を作成及び保存管理するためのシステム
(3) 製造工程を制御又は管理するためのシステム及びその管理データを保存管理するためのシステム
(4) 原材料及び製品の保管、出納等の生産を管理するシステム
(5) 品質試験に用いる機器を制御又は管理するためのシステム並びに品質試験結果及び管理データを保存管理するためのシステム
(6) 空調、製造用水製造設備など、製品の品質に重大な影響を及ぼす可能性のある製造支援設備・施設を制御又は管理するためのシステム及びその管理データを保存管理するためのシステム
(7) 文書(手順書類、品質標準書、製品標準書等)を作成、承認、保存管理するためのシステム
医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン
バリデーションとは、製造工程及びその手順を検証して文書化することです。
検証を行い証拠となる文書を作成することにより、継続的に証拠を積み上げ高度な品質を保証していくことをバリデーションといいます。
「バリデーション」とは、製造所の構造設備並びに手順、工程その他の製造管理及び品質管理の方法が期待される結果を与えることを検証し、これを文書とすることをいう。
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令
差分の機能仕様書や設計仕様書を作成してはならない。
最新の当該システムの機能がどうなっているかを一瞥して分かるようにしておかなければならないのである。<省略>
計画書、報告書、仕様書等は、最新バージョンのみをバインダーに綴じておかなければならない。
それに対して、テストスクリプトやテストログは全てのバージョンをバインダーに綴じておかなければならない。
なぜならば、最新のテストログのみを綴じておくとすべてのテストが合格しているからである。
規制当局のレビュでは、成功したテストを調査したいのではなく、エラーになったテストを参照し、解決された経緯を調査したいためである。
【ワンポイント】CSVにおける成果物の種類と管理方法 – eCompress
バリデーションの対象となるのは、開発したシステム自体だけではなくそれを使用する業務プロセスも含みます。
コンピュータ化されたシステム(Computerized System)とは、「コンピュータシステム」と「業務プロセス」を統合したものである。
「コンピュータシステム」は、ハードウェアとソフトウェアから構成され「業務プロセス」は、人、標準業務手順書(SOP)と、設備(例えば測定機器、CRF、筆記具など)から構成される。
コンピュータバリデーションとは イーコンプライアンス
目的は、システムが意図したとおりに動作することを保証することです。
「医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準に関する省令」及びGMP省令に基づく業務を行うためのコンピュータ化システムの要件を明確にし、
コンピュータ化システムが意図したとおりに動作することを保証するため、これを開発する際に必要な事項、これを検証するバリデーションに関する事項及び運用管理に関する遵守事項を定め、GQP省令及びGMP省令の適正な実施の確保を図ることを目的とする。このガイドラインにおいては、コンピュータ化システムの開発から、検証、運用管理及び廃棄までの流れを総合してコンピュータ化システムのライフサイクルという。
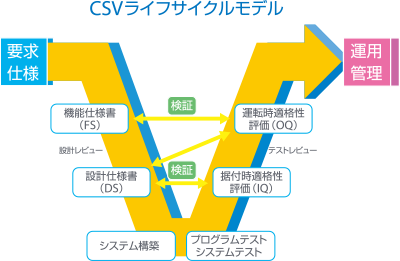
医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン コンピュータ化システムのライフサイクルモデル
薬や医療機器の品質保証のために、システムの開発から導入および廃棄までを検証・文書化します。
CSVで重要なことは、開発から廃棄までを検証して証拠として文書を残すことです。
それによって薬や医療機器の品質に問題がないことを保証します。
医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン カテゴリ分類表と対応例
CSVではドキュメントがたくさん必要となるため、ユーザ企業とシステムを作る企業の間で成果物のイメージに相違がないことを確認することが作業量のズレ防止に大きく繋がります。
サプライヤが、ユーザ企業から CSV 活動のサポート(アウトソーシング)に関する見積依頼を受けた際に困る点を次に例示する。
●漠然とした要求で何をサポートして欲しいのかがよくわからない
●ユーザ企業とサプライヤの役割分担と責任範囲が明確になっていない
● CSV に関する規範が明確になっていない
● CSV を行うコンピュータ化システムに関する情報が不十分である(省略)
サプライヤが精度の高い見積を行う上で最低限必要な情報を、次に示す。
●当該コンピュータ化システムがどの規制に準拠すればよいのか
●CSV 活動はユーザ企業の規定あるいはサプライヤの方法に任せるのか
●当該コンピュータ化システムの GAMP のカテゴリ分類、システム規模や複雑さ
●成果物(バリデーションドキュメント)
CSV におけるサプライヤの役割
そんなCSVにはガイドラインがあります。
国際的にはGAMPというものがあります。
- 正式 : Good Automated Manufacturing Practice
ISPE(国際製薬技術協会)が作っていて、欧米ではこのGAMPの考え方が広く使われていて世界標準的なガイドラインです。
日本には「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」というものがあります。
ガイドラインなので法的拘束力はありませんが、海外のガイドラインとも整合性があり世界的にも通用するものです。
GAMPとどう違うかはよくわかりません。
このガイドラインは欧米のGAMP5やPIC/S等のCSVガイドラインと整合性があり、コンピュータ化システムの開発から検証、運用、廃棄までのライフサイクルの考え方を採用しています。
CSVとは。コンピュータ化システムバリデーションとは
製薬や医療業界のシステム開発で使われる工程の略称
各工程の名前や略称は会社やプロジェクトによって異なりますが、CSVを実施している製薬や医療業界ではGAMP4の用語を各工程の略称として使用していることがあります。
最新のGAMP5ではこの略称の一部は記載されなくなったためいつかなくなるかもしれませんが・・・。
| 日本語の工程名 | (GMP4の略称)英語の工程名 | ポイント |
|---|---|---|
| 設計適格性確認 | (DQ)Design Qualification | テスト工程になって仕様変更が発生しないよう開発ベンダは「作成する要求仕様書」と供給業者から提出される「設計仕様書」が合致しているかどうかを確認し、その記録を残すことが重要 |
| ユーザ要求仕様 | (URS)User Required Specification | 要求仕様書の作成には関係部門が連携して、必要事項を漏れなくまとめていくことが大切 |
| システム機能仕様 | (FS)Functional Specification | 作成はサプライヤがしてもそのレビューと承認はユーザ企業(製薬企業、医療機器企業)の責任である |
| システム設計仕様 | (DS)Design Specification | - |
| 実装/単体テスト | - | - |
| 据付時適格性確認(結合テスト) | (IQ)Installation Qualification | 設計仕様書等に記載された通りに据え付けられ、プログラムがインストールされたことを確認して記録を残す |
| 運転時適格性確認(機能テスト) | (OQ)Operational Qualification | |
| 性能適格性確認(要件テスト) | (PQ)Performance Qualification | 承認された条件下で作業を行って動作できることを確認して記録を残す |